Laser-Scanning-Mikroskopie
Hintergrund des Projektes
Jedes Jahr erkranken ca. 500.000 Menschen in Deutschland an Krebs. Die Diagnostik und die Behandlung entwickeln sich stetig. Derzeit werden Operationen, Chemotherapie und Radiotherapie als Standardbehandlungsmöglichkeiten eingesetzt. Die Immuntherapie mittels therapeutischer Antikörper und gentechnisch veränderter, körpereigener Immunzellen (CAR-T-Zellen) rückte jüngst in den Fokus.
Die Unterscheidung zwischen gesundem Gewebe und Tumorgewebe ist oft nicht einfach vorzunehmen. Ziel der Operation von Tumoren ist es, tumorfreie Resektionsränder bei gleichzeitigem gesteigertem Erhalt des umliegenden, gesunden Gewebes zu erhalten. Mögliche Probleme dabei sind folgende:
- Abgrenzung von gesundem und tumorartigem Gewebe wird vom Operateur subjektiv eingeschätzt
- 3-Dimensionale Darstellung des Tumorrandes ist nicht möglich
- Histologie erfolgt zumeist postoperativ
- Schnellschnitte während der Operation sind zwar möglich, aber
- Schnitte geben lediglich Hinweise
- Gefrierschnitte von Fettgewebe sind technisch schwierig
- Mindestprobengrößen erforderlich
- Einige Gewebe können gar nicht verarbeitet werden (z.B. Knochen)
- Intraoperative Anwendung je nach Transportweg zeitlich aufwendig
Projektziel
Entwicklung einer leicht anwendbaren, optischen Methode, die:
- intraoperativ gesunde Gewebestrukturen von Tumorgewebe unterscheidet.
- den vollständigen Erhalt von Hirnnerven und Arterien während, z.B. neurochirurgischer Eingriffe gewährleistet.
- eine spezifische Anfärbung von Tumorgewebe erlaubt.
- Bildübersichten in 3D- von Tumor- und Tumorrandbereichen intraoperativ erstellt.
- in einem akzeptablen Zeitrahmen verlässliche Ergebnisse visualisiert.

Projektidee
Aufnahme optischer Schnittbilder mithilfe konfokaler MEMS-basierter Laser-Fluoreszenzmikroskopie in vivo.
Projektumsetzung
Mikroskop-Entwicklung
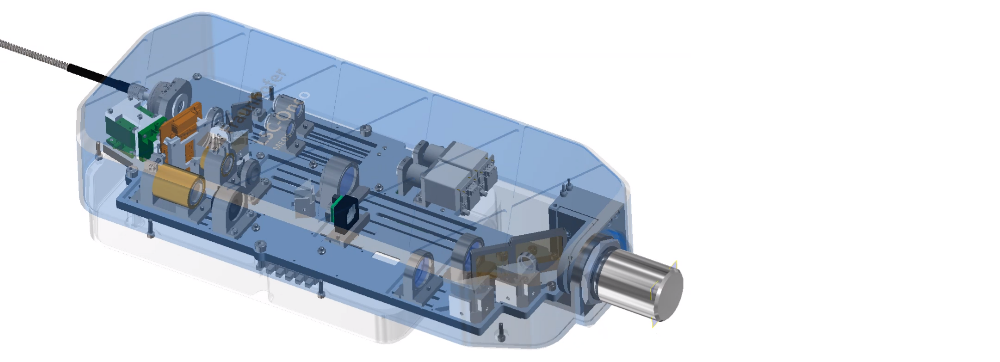
Im Rahmen des Projektes soll ein Labordemonstrator eines miniaturisierten konfokalen Laserscanning-Mikroskops entwickelt werden. Die Vorteile der Entwicklung sollen in der Verwendung eines am Fraunhofer IPMS entwickelten MEMS-Bauteils (Mikro-Elektro-Mechanisches System) und damit in der Miniaturisierung und der preisgünstigeren Herstellung im Vergleich zu Konkurrenztechnologien liegen. Der Proof-of-concept für ein robustes MEMS-basiertes Fluoreszenz-Laser-Scanning-Mikroskop wurde bereits erbracht²,³ und patentrechtlich geschützt (Patent DE102013222349B3 vom 05.02.2015).
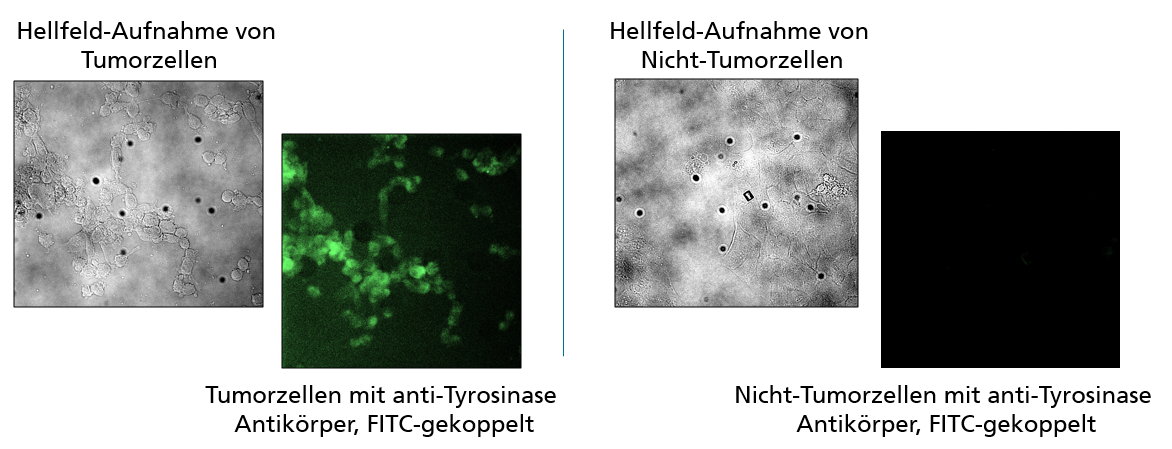
Unterscheidung von Tumor- und gesundem Gewebe
Die Weiterentwicklung des Demonstrators soll eine Anwendung bei operativ zugänglichen Tumoren (z.B. Hirn- oder Hauttumore) erlauben. Hierfür wird zunächst am Fraunhofer IZI eine Methode zur spezifischen Anfärbung von Tumorzellen mittels fluoreszenz-markierter Antikörper auf Zellkulturebene etabliert. In einem nächsten Schritt soll Patientenmaterial genutzt und die spezifische Färbung der Tumorzellen an 2D-Schnitten von Patientenmaterial verstetigt werden. Anschließend wird die Einsatzmöglichkeit des Demonstrators an 3D-Gewebeproben von Patienten außerhalb des Körpers (ex vivo) untersucht, um eine Anwendbarkeit intraoperativ am Patienten (in vivo) zu erarbeiten.
Recherche: Fraunhofer IZI, Fluoreszenzfarbstoffe - im Menschen zugelassen
| Farbstoff | Wellenlänge | Bemerkung |
| Fluorescein | Absorptionsmaximum: 485 nm (pH 9) Emissionsmaximum: 514 nm (pH 9) |
|
| Indocyaningrün (ICG) | Absorptionsmaximum: 600 – 900nm Emissionsmaximum: 750 – 950 nm |
|
Projektergebnis
Der realisierte LSC-Demonstrator kann über ein speziell programmiertes User-Interface betrieben werden. Er nimmt Fluoreszenz-Bilder bei zwei Laserwellenlängen (488 nm, 638 nm) auf und ist zudem mit einer Systemkamera inkl. Koehler-Beleuchtung ausgestattet.
Von Mitarbeitenden des Fraunhofer IZI wurden Recherchen zu geeigneten Fluoreszenzfarbstoffen sowie zu tumorspezifischen Antikörperfärbungen durchgeführt. Nach ersten erfolgreichen Tests an fixierten Zellen aus Zellkulturen wurde eine Kooperation mit dem Helios Klinikum Erfurt initiiert, die nach positivem Ethikvotum Tumorproben zur Erprobung des Gesamtsystems bereitstellten.
Der gesamte LSC-Onco-Demonstrator besteht aus einem optischen Scankopf und einem Versorgungsmodul (inkl. Laser und Stromversorgung). Der mobile Scankopf mit einem Gesamtgewicht < 5 kg ist auf einer automatisierten x/y/z-Stage montiert und kann per Joystick bzgl. der Probe positioniert werden.
Alle im Projekt geplanten Arbeiten zur Demonstratorentwicklung und in vitro Testung an fixierten humanen Zellen aus Zellkultur und Schnitten von Patientenmaterial sind erfolgreich abgeschlossen.
Der Demonstrator LSC-Onco steht zur weiteren Evaluierung von Tumorgeweben (und anderen Indikationen) am Fraunhofer-Zentrum MEOS zur Verfügung.
Referenzen
1. Falco, J. et al. Fluorescein Application in Cranial and Spinal Tumors Enhancing at Preoperative MRI and Operated With a Dedicated Filter on the Surgical Microscope: Preliminary Results in 279 Patients Enrolled in the FLUOCERTUM Prospective Study. Frontiers in surgery 6, 49; 10.3389/fsurg.2019.00049 (2019).
2. Bechtel, C., Knobbe, J., Grüger, H. & Lakner, H. Large field of view MEMS-based confocal laser scanning microscope for fluorescence imaging. Optik 125, 876–882; 10.1016/j.ijleo.2013.07.091 (2014).
3. Bechtel, C. Development of a MEMS-based confocal laser scanning microscope for fluorescence imaging. Zugl.: Dresden, Techn. Univ., Diss., 2014 (TUDpress Verl. der Wiss, Dresden, 2015).
4. Cavallo, C. et al. The utilization of fluorescein in brain tumor surgery: a systematic review. Journal of neurosurgical sciences 62, 690–703; 10.23736/S0390-5616.18.04480-6 (2018).
5. Yannuzzi, L. A. Indocyanine green angiography: a perspective on use in the clinical setting. American journal of ophthalmology 151, 745-751.e1; 10.1016/j.ajo.2011.01.043. (2011).
6. Porcu, E. P. et al. Indocyanine green delivery systems for tumour detection and treatments. Biotechnology advances 34, 768–789; 10.1016/j.biotechadv.2016.04.001. (2016).
Weiterführende Informationen:
- Entwicklung und Fertigung von MEMS und MOEMS am Fraunhofer IPMS (ipms.fraunhofer.de)
 Fraunhofer-Zentrum für Mikroelektronische und Optische Systeme für die Biomedizin
Fraunhofer-Zentrum für Mikroelektronische und Optische Systeme für die Biomedizin
